
Опубликовано новое исследование особенностей его генома и сценарии возникновения
Со времени первых сообщений о новой пневмонии (COVID-19) в Ухане, провинция Хубэй, China, состоялось значительное обсуждение происхождения возбудительного вируса, SARS-CoV-23 (также называемого HCoV-19). В настоящее время широко распространены инфекции с SARS-CoV-2, и по состоянию на 11 марта 2020 года в более чем 110 странах было подтверждено 121 564 случая заболевания, в которых погибло 4373 человек.
SARS-CoV-2 является седьмым коронавирусом, который, как известно, заражает человека; SARS-CoV, MERS-CoV и SARS-CoV-2 могут вызывать тяжелые заболевания, тогда как HKU1, NL63, OC43 и 229E связаны с легкими симптомами. Здесь мы рассмотрим, что можно сделать относительно происхождения SARS-CoV-2 из сравнительного анализа геномных данных. Мы предлагаем взгляд на заметные особенности генома SARS-CoV-2 и обсуждаем сценарии, с помощью которых они могли возникнуть. Наши анализы ясно показывают, что SARS-CoV-2 не является лабораторной конструкцией или целенаправленно манипулируемым вирусом.
Заметные особенности генома SARS-CoV-2
Наше сравнение альфа- и бетакоронавирусов выявляет две заметные геномные особенности SARS-CoV-2: (i) на основе структурных исследований и биохимических экспериментов, SARS-CoV-2, по-видимому, оптимизированы для связывания с ACE2 рецепторов человека; И (ii) спиковый белок SARS-CoV-2 имеет функциональный полибазный (фуриновый) сайт расщепления на границе S1-S2 путем введения 12 нуклеотидес8, что дополнительно приводит к предсказанному приобретению трех O-связанных гликанов вокруг сайта.
1. Мутации в рецепторно-связывающем домене SARS-CoV-2
Рецепторно-связывающий домен (RBD) в скипидарном белке является наиболее вариабельной частью геном коронавируса. Было показано, что шесть RBD-аминокислот являются критическими для связывания с ACE2 рецепторами и для определения диапазона хозяев SARS-CoV-подобных вирусов. С координатами на основе SARS-CoV они - Y442, L472, N479, D480, T487 и Y4911, которые соответствуют L455, F486, Q493, S494, N501 и Y505 в SARS-CoV-27. Пять из этих шести остатков различаются между SARS-CoV-2 и SARS-CoV (фиг.1a). На основе структурных исследований и биохимических экспериментов SARS-CoV-2, по-видимому, имеет RBD, который связывается с высоким сродством к ACE2 от человека, хорьков, кошек и других видов с высоким гомологом рецепторов.
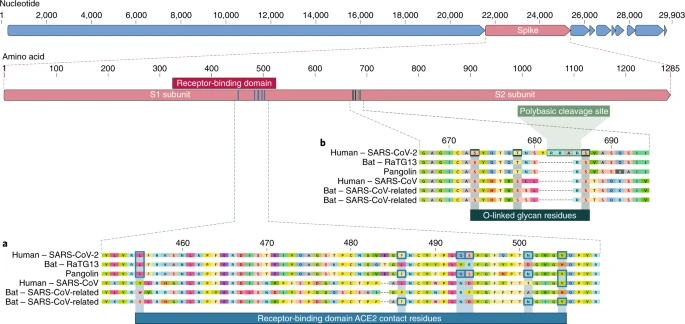
Рис. 1: Особенности белка шипа в SARS-CoV-2 человека и родственных коронавирусов
А. Мутации в контактных остатках белка шипа SARS-CoV-2. Спайковый белок SARS-CoV-2 (красная планка сверху) был выровнен против наиболее тесно родственных SARS-CoV-подобных коронавирусов и самого SARS-CoV. Ключевые остатки в скипидарном белке, которые контактируют с рецептором ACE2, маркируются синими вставками как в SARS-CoV-2, так и в родственных вирусах, включая SARS-CoV (штамм Urbani). B. Получение сайта полибазного расщепления и O-связанных гликанов. Как полибазный сайт расщепления, так и три смежных предсказанных O-связанных гликана являются уникальными для SARS-CoV-2 и не были ранее замечены в линии В бетакоронавирусов. Показанные последовательности от NCBI GenBank, кодов MN908947, MN996532, AY278741, KY417146 и MK211376 вступления. Последовательности коронавируса ящера - согласие, произведенное от SRR10168377 и SRR10168378 (Биопроект PRJNA573298 NCBI).
Хотя приведенные выше анализы показывают, что SARS-CoV-2 могут связывать ACE2 человека с высоким сродством, вычислительные анализы предсказывают, что взаимодействие не идеало7 и что последовательность RBD отличается от последовательности, показанной в SARS-CoV, чтобы быть оптимальной для связывания рецептора. Таким образом, высокое аффинное связывание белка SARS-CoV-2 шипа с человеческим ACE2, скорее всего, является результатом естественного отбора на человеке или человекоподобном ACE2, который позволяет получить другой оптимальный раствор связывания. Это убедительное свидетельство того, что SARS-CoV-2 не является продуктом целенаправленных манипуляций.
2. Сайт расщепления полибазным фурином и O-связанными гликанами
Второй заметной особенностью SARS-CoV-2 является полибазный сайт расщепления (RRAR) на стыке S1 и S2, двух субъединиц линии 8 (фиг.1b). Это позволяет эффективно расщеплять фурином и другими протеазами и играет роль в определении вирусной инфекционности и диапазона хозяев12. Кроме того, ведущий пролайн также вставляется на этом участке в SARS-CoV-2; Таким образом, вставленной последовательностью является PRRA (фиг.1b). Поворот, создаваемый пролином, прогнозируется в результате добавления O-связанных гликанов к S673, T678 и S686, которые отходят от сайта расщепления и являются уникальными для SARS-CoV-2 (фиг.1b). Полибазные сайты расщепления не наблюдались у родственных "lineage B" бетакоронавирусов, хотя другие бетакоронавирусы человека, включая HKU1 (lineage A), имеют эти сайты и предсказанные O-связанные гликаны13. Учитывая уровень генетической вариации скачка, вероятно, что SARS-CoV-2-like вирусы с частичными или полными полибазными сайтами расщепления будут обнаружены у других видов.
Функциональное следствие сайта полибазного расщепления в SARS-CoV-2 неизвестно, и будет важно определить его влияние на трансмиссивность и патогенез на моделях животных. Эксперименты с SARS-CoV показали, что вставка сайта расщепления фурина в S1-S2 точке соединения усиливает слияние клеток без воздействия на вирусный центр. Кроме того, эффективное расщепление спика MERS-CoV позволяет MERS-подобным коронавирусам от летучих мышей заражать клетки человека. В вирусах птичьего гриппа быстрая репликация и передача в высокоплотных популяциях курицы выбирает для приобретения полибазные сайты расщепления в гемагглютинине (HA) протеин16, который выполняет функцию, аналогичную функции белка коронавируса. Получение полибазных сайтов расщепления в HA путем вставки или рекомбинации превращает вирусы птичьего гриппа с низкой патогенностью в высокопатогенные формы. Приобретение сайтов полибазного расщепления с помощью HA также наблюдалось после повторного прохождения в клеточной культуре или через анимальсы.
Функция предсказанных O-связанных гликанов неясна, но они могут создать "муцин-подобный домен", который экранирует эпитопы или ключевые остатки на протеине SARS-CoV-2 шипа. Некоторые вирусы используют муциноподобные домены в качестве гликанных щитов, участвующих в иммуноэвази. Хотя предсказание О-связанного гликозилирования является устойчивым, необходимы экспериментальные исследования для определения, используются ли эти сайты в SARS-CoV-2.
Теории SARS-CoV-2 происхождения
Маловероятно, что SARS-CoV-2 возник посредством лабораторных манипуляций с родственным SARS-CoV-подобным коронавирусом. Как отмечено выше, RBD SARS-CoV-2 оптимизирован для связывания с человеческим ACE2 с эффективным решением, отличным от ранее предсказанных. Кроме того, если бы были проведены генетические манипуляции, то, вероятно, была бы использована одна из нескольких обратногенетических систем, доступных для бетакоронавирусов. Однако генетические данные неопровержимо показывают, что SARS-CoV-2 не является производным от какого-либо ранее использованного вируса backbone. Вместо этого мы предлагаем два сценария, которые вполне могут объяснить происхождение SARS-CoV-2: И ii) естественный отбор у человека после зоонозного переноса. Мы также обсуждаем, мог ли отбор во время прохождения вызвать SARS-CoV-2.
1. Естественный отбор у животного-хозяина перед зоонозным переносом
Поскольку многие ранние случаи COVID-19 были связаны с рынком Хуанань в Wuhan, не исключено, что на этом месте присутствовал источник животного происхождения. Учитывая сходство SARS-CoV-2 с SARS-CoV-подобными коронавирус2, вероятно, что летучие мыши служат хозяевами резервуаров для своего предшественника. Несмотря на то, что RaTG13, отобранный из палочки Rhinolophus affinis, в целом на 96% идентичен SARS-CoV-2, его скачок расходится в RBD, что говорит о том, что он может не связываться эффективно с ACE27 человека (фиг.1а).
Малайские панголины (Manis javanica), незаконно ввезенные в провинцию Гуандун, содержат коронавирусы, подобные SARS-CoV-221. Хотя вирус RaTG13 летучих мышей остается наиболее близким к SARS-CoV-2 по геноме1, некоторые панголиновые коронавирусы проявляют сильное сходство с SARS-CoV-2 в RBD, включая все шесть ключевых остатков RBD 21 (рис. 1). Это ясно показывает, что белок всплеска SARS-CoV-2, оптимизированный для связывания с человекоподобными ACE2, является результатом естественного отбора.
Ни баты бетакоронавирусы, ни панголин бетакоронавирусы, отобранные до настоящего времени, не имеют полибасных сайтов расщепления. Хотя не было выявлено ни одного животного коронавируса, достаточно похожего, чтобы служить прямым предшественником SARS-CoV-2, разнообразие коронавирусов у летучих мышей и других видов массово недооценивается. Мутации, инсерции и делеции могут происходить вблизи S1-S2 соединения коронавирусов 22, что показывает, что полибазный сайт расщепления может возникнуть естественным эволюционным процессом. Для того чтобы вирус-предшественник приобрел как сайт полибазного расщепления, так и мутации в скипидарном белке, пригодном для связывания с человеческим ACE2, животному-хозяину, вероятно, придется иметь высокую плотность популяции (чтобы обеспечить эффективный естественный отбор) и ACE2-encoding ген, который аналогичен человеческому ортологу.
2. Естественный отбор у человека после зоонозного переноса
Возможно, что предшественник SARS-CoV-2 прыгал в человека, приобретая описанные выше геномные особенности посредством адаптации во время необнаруженной передачи от человека к человеку. После того, как эти изменения будут получены, пандемия сможет взлететь и создать достаточно большую группу случаев, чтобы спровоцировать систему наблюдения, обнаружившую их.
Все SARS-CoV-2 геномы, секвенированные до сих пор, имеют описанные выше геномные особенности и, таким образом, получены от общего предка, у которого они тоже были. Присутствие в панголинах RBD, очень похожего на SARS-CoV-2, означает, что мы можем сделать вывод, что это было также, вероятно, в вирусе, который подскочил к людям. Это оставляет возможность введения сайта полибазного расщепления в процессе передачи от человека к человеку.
Оценки времени появления самого последнего общего предка SARS-CoV-2, сделанные с помощью текущих данных о последовательности, указывают на появление вируса в конце ноября 2019 года - начале декабря 201923 года, совместимые с самыми ранними ретроспективно подтвержденными кейсами 24. Следовательно, этот сценарий предполагает период неопознанной передачи у человека между первоначальным зоонозным событием и приобретением сайта полибазного расщепления. Достаточные возможности могли бы возникнуть, если бы было много предыдущих зоонозных событий, которые приводили к коротким цепочкам передачи от человека к человеку в течение длительного периода. Это, по сути, ситуация для MERS-CoV, для которого все человеческие случаи являются результатом повторных скачков вируса от дромедарных верблюдов, продуцирующих единичные инфекции или короткие цепи передачи, которые в конечном итоге разрешаются, без адаптации к устойчивой трансмиссии.
Исследования образцов, полученных с помощью банок, могут дать информацию о том, имело ли место такое распространение крипты. Ретроспективные серологические исследования также могут быть информативными, и было проведено несколько таких исследований, показывающих низкоуровневое воздействие коронавирусов, подобных SARS-CoV, в некоторых областях China26. Критически, однако, эти исследования, возможно, не различили, были ли воздействия из-за предшествующих заражений SARS-CoV, SARS-CoV-2 или другими коронавирусами SARS-CoV-like. Необходимо провести дополнительные серологические исследования для определения степени предварительного воздействия SARS-CoV-2 на человека.
3. Выбор во время прохода
В течение многих лет в лабораториях 2 уровня биобезопасности по всему миру проводятся фундаментальные исследования, связанные с прохождением БАТ-КоВ-подобных коронавирусов в клеточной культуре и/или моделях животных, и имеются документальные примеры лабораторных побегов SARS-CoV28. Поэтому мы должны изучить возможность непреднамеренного лабораторного высвобождения SARS-CoV-2.
Теоретически, возможно, что SARS-CoV-2 приобрели мутации RBD (рис. 1а) во время адаптации к проходу в клеточной культуре, как было отмечено в исследованиях SARS-CoV11. Находка SARS-CoV-подобных коронавирусов из панголинов с почти идентичными RBD, однако, дает гораздо более сильное и парсимоническое объяснение того, как SARS-CoV-2 приобрели их посредством рекомбинации или мутации.
Получение как сайта полибазного расщепления, так и предсказанных O-связанных гликанов также имеет отношение к сценариям, основанным на культуре. Новые полибазные сайты расщепления наблюдались только после длительного прохождения вируса птичьего гриппа с низкой патогенностью in vitro или in vivo17. Кроме того, гипотетическое поколение SARS-CoV-2 с помощью клеточной культуры или прохождения животных потребовало бы предварительного выделения вируса-предшественника с очень высоким генетическим сходством, которое не было описано. Последующее создание сайта полибазного расщепления потребовало бы повторного прохождения в клеточной культуре или животных с ACE2 рецепторами, аналогичными рецепторам человека, но такая работа также не была описана ранее. Наконец, генерация предсказанных O-связанных гликанов также маловероятна из-за прохождения клеточной культуры, так как такие признаки предполагают участие иммунной системы.
Заключение
В условиях глобальной COVID-19 чрезвычайной ситуации в области здравоохранения разумно задаться вопросом о том, почему происхождение пандемии имеет значение. Детальное понимание того, как вирус животного перескочил границы видов, чтобы так продуктивно заразить человека, поможет в предотвращении будущих зоонозных событий. Например, если SARS-CoV-2 предварительно адаптированы у другого вида животных, то есть риск будущих событий повторного появления. Напротив, если адаптивный процесс произошел у человека, то даже если происходят повторные зоонозные передачи, они вряд ли взлетят без той же серии мутаций. Кроме того, выявление ближайших вирусных родственников SARS-CoV-2, циркулирующих у животных, во многом поможет исследованиям вирусной функции. Действительно, наличие RaTG13 последовательности летучих мышей помогло выявить ключевые мутации RBD и сайт полибазного расщепления.
Геномные особенности, описанные здесь, могут частично объяснить инфекционность и переносимость SARS-CoV-2 у человека. Хотя данные свидетельствуют о том, что SARS-CoV-2 не является целенаправленно манипулируемым вирусом, в настоящее время невозможно доказать или опровергнуть другие теории его происхождения, описанные здесь. Однако, поскольку мы наблюдали все заметные SARS-CoV-2 особенности, включая оптимизированный RBD и полибазный сайт расщепления, в родственных коронавирусах в природе, мы не считаем, что какой-либо тип лабораторного сценария является правдоподобным.
Больше научных данных может изменить баланс доказательств, чтобы отдать предпочтение одной гипотезе над другой. Получение родственных вирусных последовательностей из животных источников было бы наиболее окончательным способом выявления вирусного происхождения. Например, будущее наблюдение промежуточного или полностью сформированного сайта полибазного расщепления в вирусе SARS-CoV-2-like у животных могло бы еще больше подкрепить гипотезы естественного отбора. Было бы также полезно получить больше генетических и функциональных данных о SARS-CoV-2, включая исследования на животных. Идентификация потенциального промежуточного хозяина SARS-CoV-2, а также секвенирование вируса из очень ранних случаев также были бы весьма информативными. Независимо от конкретных механизмов, с помощью которых SARS-CoV-2 возникает при естественном отборе, постоянное наблюдение за пневмонией у людей и других животных, безусловно, имеет исключительно важное значение.
Источник
no subject
Date: 2020-03-18 11:34 am (UTC)no subject
Date: 2020-03-18 11:44 am (UTC)no subject
Date: 2020-03-18 12:07 pm (UTC)